Salud Dispositivos Médicos Biotecnología

Mercado de pruebas de dispositivos médicos

Tamaño del mercado de pruebas de dispositivos médicos, participación, crecimiento y análisis de la industria, por servicio (pruebas, inspección, certificación, otros), por abastecimiento (interno, subcontratado), por clase de dispositivo (Clase I, Clase II, Clase III), por Tecnología y Análisis Regional, 2024-2031
Páginas : 148
Año base : 2023
Lanzamiento : October 2024
ID del informe: KR147
Tamaño del mercado de pruebas de dispositivos médicos
El tamaño del mercado mundial de pruebas de dispositivos médicos se valoró en 11,44 mil millones de dólares en 2023 y se prevé que crezca de 12,03 mil millones de dólares en 2024 a 17,71 mil millones de dólares en 2031, exhibiendo una tasa compuesta anual del 5,68% durante el período de pronóstico. El mercado se está expandiendo debido a las rápidas innovaciones tecnológicas y la creciente complejidad de los dispositivos médicos. Este crecimiento se ve impulsado aún más por el aumento del escrutinio regulatorio sobre la seguridad y la calidad, especialmente en los mercados emergentes.
Además, el creciente interés en la medicina personalizada y la integración de IoT en los dispositivos sanitarios están impulsando la demanda de pruebas precisas y exhaustivas, garantizando el cumplimiento de los estándares industriales en evolución.
En el ámbito de trabajo, el informe incluye soluciones ofrecidas por empresas como SGS Société Générale de Surveillance SA, Laboratory Corporation of America Holdings, Nelson Laboratories, LLC, TÜV SÜD, Charles River Laboratories., North American Science Associates, LLC, Eurofins Scientific , Pace Analytical Services LLC, Intertek Group Plc, WuXi AppTec y otros.
El mercado de pruebas de dispositivos médicos está experimentando un crecimiento significativo, impulsado por la creciente demanda de dispositivos avanzados debido a la creciente prevalencia de enfermedades crónicas como la diabetes y las afecciones cardiovasculares.
- A partir de 2023, el Instituto de Medición y Evaluación de la Salud (IHME) informa que más de 500 millones de personas en todo el mundo tienen diabetes, una cifra que se prevé superará los 1.300 millones en los próximos 30 años, lo que afectará a todos los países. La tasa de prevalencia mundial actual es del 6,1%, siendo el norte de África y Oriente Medio la tasa más alta, con un 9,3%, y se prevé que aumente al 16,8% para 2050. Además, se espera que América Latina y el Caribe vean aumentar sus tasas al 11,3%. .
Los sistemas de salud enfrentan desafíos en el manejo de estas condiciones a largo plazo, lo que resalta la necesidad de dispositivos médicos confiables y de alta calidad. Los requisitos regulatorios más estrictos para la seguridad y eficacia de los dispositivos, junto con los avances tecnológicos en inteligencia artificial y automatización, están impulsando el crecimiento del mercado.
El cambio hacia las pruebas centradas en el paciente y el enfoque global en mejorar la infraestructura sanitaria están contribuyendo aún más a la creciente demanda de servicios integrales de pruebas de dispositivos médicos.
Las pruebas de dispositivos médicos se refieren a los procesos de evaluación integrales realizados para garantizar la seguridad, la funcionalidad y el cumplimiento de los dispositivos antes de su introducción en el mercado. Esta prueba incluye varias evaluaciones, como pruebas de rendimiento, biocompatibilidad, integridad mecánica yesterilizaciónValidación para cumplir con los estándares regulatorios establecidos por autoridades como la FDA y la EMA.
Garantiza que los dispositivos funcionen eficazmente en entornos médicos, abordando tanto la seguridad del paciente como la confiabilidad del producto. A medida que la tecnología médica se vuelve cada vez más compleja, es esencial realizar pruebas rigurosas para evitar fallos de funcionamiento y garantizar que los dispositivos cumplan con los requisitos normativos y de calidad durante todo su ciclo de vida.
Revisión del analista
Las crecientes asociaciones y el establecimiento de nuevos laboratorios por parte de actores clave fomentarán el crecimiento del mercado de pruebas de dispositivos médicos en los próximos años.
- En junio de 2023, TÜV SÜD, un destacado proveedor de servicios de certificación, auditoría y pruebas, inauguró un nuevo laboratorio de última generación en New Brighton, Minnesota. Esta instalación está acreditada según la norma ISO 17025 para pruebas biológicas y químicas de dispositivos médicos. El lanzamiento refleja el compromiso continuo de TÜV SÜD de brindar servicios de dispositivos médicos de alta calidad con precisión y propósito.
Las colaboraciones entre organizaciones de atención médica, instituciones de investigación y empresas de tecnología permiten compartir experiencia y recursos, fomentando la innovación en metodologías de prueba y ampliando las capacidades de prueba. Estos desarrollos garantizan tiempos de respuesta más rápidos y una mayor precisión de las pruebas, satisfaciendo la creciente demanda de dispositivos médicos de alta calidad, que se espera que impulse el crecimiento del mercado.
Factores de crecimiento del mercado de pruebas de dispositivos médicos
Las regulaciones más estrictas de las autoridades sanitarias como la FDA y la EMA están estimulando el crecimiento del mercado de pruebas de dispositivos médicos al garantizar que todos los dispositivos se sometan a rigurosas evaluaciones de seguridad y eficacia. Estas regulaciones exigen pruebas exhaustivas en cada etapa del ciclo de vida del producto, desde el desarrollo hasta la vigilancia posterior a la comercialización, para cumplir con los estándares.
Las empresas se ven obligadas a invertir en servicios de pruebas integrales para obtener la aprobación regulatoria y el acceso al mercado, especialmente porque el incumplimiento puede resultar en costosas demoras o retiradas de productos.
- En abril de 2023, Nelson Labs, un proveedor líder de servicios de consultoría y pruebas de química analítica y microbiológica para las industrias farmacéutica y de dispositivos médicos, recibió la acreditación ASCA de la Administración de Alimentos y Medicamentos de EE. UU. (FDA) como laboratorio de pruebas de biocompatibilidad.
El creciente interés en la seguridad del paciente y el control de calidad está impulsando la demanda de soluciones de pruebas avanzadas y contribuyendo al crecimiento del mercado.
El mercado enfrenta desafíos debido a estrictos requisitos regulatorios y altos costos de cumplimiento. Navegar por regulaciones complejas puede resultar desalentador para los fabricantes, lo que genera posibles retrasos en el desarrollo de productos y la entrada al mercado. Además, la necesidad de métodos de prueba avanzados para cumplir con los estándares en evolución puede sobrecargar los recursos y aumentar los gastos operativos.
Para mitigar estos desafíos, los actores clave están invirtiendo en automatización y tecnologías digitales para optimizar los procesos de prueba y mejorar la eficiencia. Las colaboraciones mejoran las capacidades de cumplimiento al ofrecer servicios integrados que abordan múltiples necesidades de prueba, facilitando un desarrollo de productos más rápido y reduciendo los costos para los fabricantes.
- En marzo de 2023, Nemera y Nelson Labs Europe anunciaron una asociación para brindar a los clientes servicios integrados integrales, que incluyen lixiviables, extraíbles, microbiología, biocompatibilidad y pruebas químicas.
Se espera que estas asociaciones entre actores clave respalden el crecimiento del mercado en los próximos años.
Tendencias de la industria de pruebas de dispositivos médicos
La adopción de tecnologías digitales como la inteligencia artificial (IA) y el aprendizaje automático (ML) está impulsando el crecimiento de la industria de pruebas de dispositivos médicos al mejorar significativamente la eficiencia y precisión de las pruebas. La IA y el ML permiten el análisis de datos avanzado y el modelado predictivo, lo que permite una evaluación más precisa del rendimiento del dispositivo, posibles fallas y factores de riesgo. Esta capacidad reduce el tiempo de prueba, minimiza el error humano y mejora la calidad general de los resultados.
- En agosto de 2023, Eurofins BioPharma Product Testing se asoció con Huma para crear y proporcionar soluciones digitales de ensayos clínicos para dispositivos médicos. Esta colaboración tiene como objetivo combinar la competencia de Eurofins en pruebas de dispositivos médicos con la experiencia de Huma en ensayos clínicos digitales, permitiendo a las empresas de dispositivos médicos acelerar su entrada al mercado de productos de manera más efectiva y eficiente.
La creciente complejidad de los dispositivos médicos requiere procesos de prueba optimizados, lo que facilita aprobaciones regulatorias y lanzamientos de productos más rápidos. Esta tendencia impulsa la demanda de soluciones de prueba innovadoras, fomentando así la expansión del mercado de pruebas de dispositivos médicos.
El cambio hacia enfoques centrados en el paciente en las pruebas de dispositivos médicos está ganando impulso, y los fabricantes e investigadores involucran cada vez más a los pacientes en el proceso de prueba. La participación temprana del paciente proporciona a las empresas información valiosa sobre el uso de dispositivos en el mundo real, las preferencias de los usuarios y los puntos débiles, lo que les permite diseñar dispositivos más intuitivos y eficaces.
Este enfoque mejora la usabilidad de los dispositivos médicos y garantiza que satisfagan eficazmente las necesidades de los usuarios finales. La incorporación de comentarios de los pacientes ayuda a reducir las fallas de los dispositivos y mejora la satisfacción del paciente, lo que genera una mayor demanda en el mercado de soluciones más personalizadas y fáciles de usar.
Análisis de segmentación
Lo global se ha segmentado según el servicio, el abastecimiento, la clase de dispositivo, la tecnología y la geografía.
Por servicio
Según el servicio, el mercado se ha clasificado en pruebas, inspección, certificación y otros. El segmento de pruebas lideró el mercado de pruebas de dispositivos médicos en 2023, alcanzando una valoración de 5.440 millones de dólares. Este crecimiento está impulsado por la creciente demanda de dispositivos médicos avanzados y compatibles.
Los estrictos estándares regulatorios, particularmente de autoridades sanitarias como la FDA y la EMA, requieren pruebas exhaustivas para garantizar la seguridad y eficacia del dispositivo. La creciente prevalencia de enfermedades crónicas resalta aún más la necesidad de soluciones de prueba innovadoras. Los fabricantes están invirtiendo mucho en servicios de prueba para minimizar los riesgos asociados con fallas de los dispositivos y cumplir con los requisitos reglamentarios.
- En abril de 2022, Eurofins y SGS, destacados proveedores de servicios de pruebas de dispositivos médicos, se asociaron para ofrecer a los clientes una amplia gama de soluciones de pruebas de dispositivos médicos. Esta colaboración tiene como objetivo mejorar la presencia global de ambas empresas.
Los avances tecnológicos en las metodologías de prueba, incluida la automatización y las soluciones digitales, están mejorando la eficiencia y precisión de las pruebas, impulsando así el crecimiento del segmento.
Por clase de dispositivo
Según la clase de dispositivo, el mercado se ha clasificado en clase I, clase II y clase III. El segmento de clase II capturó la mayor proporción del 50,44% en 2023. Estos dispositivos, incluidas bombas de infusión, paños quirúrgicos y equipos de diagnóstico por imágenes, son fundamentales en diversos entornos de atención médica.
La creciente prevalencia de enfermedades crónicas, incluidas la diabetes y las afecciones cardiovasculares, requiere opciones avanzadas de seguimiento y tratamiento, lo que genera una mayor demanda de dispositivos de clase II.
Además, las innovaciones tecnológicas, como el monitoreo remoto y las soluciones de telesalud, están mejorando la funcionalidad y usabilidad de estos dispositivos. Los requisitos regulatorios más estrictos y la necesidad de validación clínica contribuyen aún más al crecimiento segmentario, ya que los fabricantes invierten en cumplimiento y pruebas para garantizar la seguridad y eficacia.
Por tecnología
Según la tecnología, el mercado se ha clasificado en dispositivos médicos de implantes activos, dispositivos médicos activos, dispositivos médicos no activos, dispositivos médicos de diagnóstico in vitro, dispositivos médicos oftálmicos, dispositivos médicos ortopédicos y dentales, y otros. Se espera que el segmento de dispositivos médicos de diagnóstico in vitro obtenga los mayores ingresos de 4.860 millones de dólares para 2031.
La mayor conciencia sobre la detección temprana de enfermedades está impulsando a los proveedores de atención médica a adoptar pruebas de diagnóstico in vitro que ofrecen diagnósticos oportunos y precisos. La creciente prevalencia de enfermedades crónicas e infecciosas impulsa la demanda de soluciones de diagnóstico innovadoras. Además, los avances en el diagnóstico molecular y la medicina personalizada están acelerando el desarrollo de productos, lo que da como resultado métodos de prueba más precisos y eficientes.
Los organismos reguladores están imponiendo rigurosos estándares de calidad, lo que lleva a los fabricantes a invertir en el cumplimiento y mejorar la eficacia del producto. Además, la tendencia hacia las pruebas en el lugar de atención está ampliando el acceso a los dispositivos IVD, haciéndolos más disponibles en todos los entornos de atención médica, fomentando así el crecimiento segmentario.
Análisis regional del mercado de pruebas de dispositivos médicos
Según la región, el mercado global se ha clasificado en América del Norte, Europa, Asia-Pacífico, MEA y América Latina.
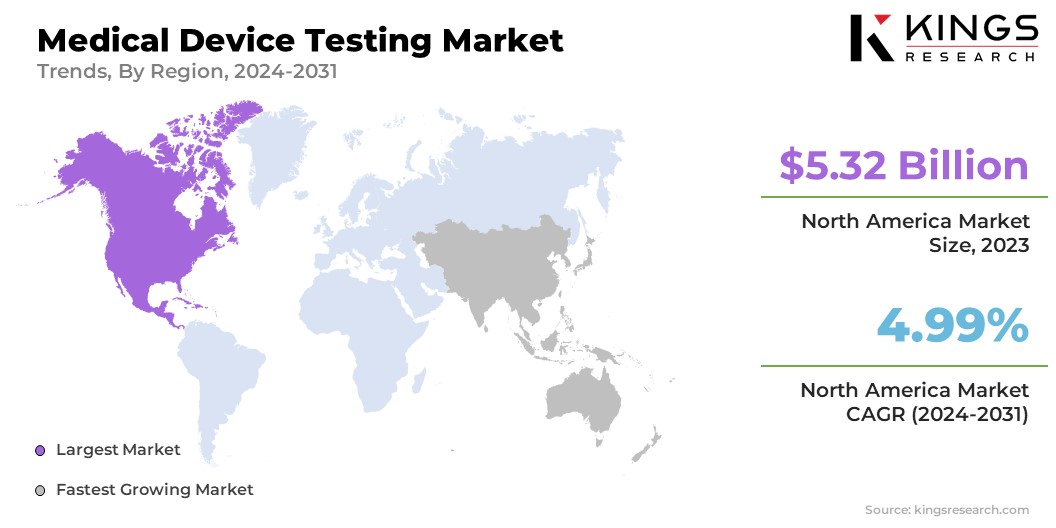
El mercado de pruebas de dispositivos médicos de América del Norte tuvo la mayor participación en los ingresos, del 46,50% en 2023, con una valoración de 5.320 millones de dólares. Este crecimiento se atribuye en gran medida al aumento de los gastos en atención médica y a un creciente enfoque en tecnologías médicas innovadoras. Además, la presencia de empresas de atención médica e instituciones de investigación líderes fomenta un entorno competitivo que promueve avances en las pruebas de dispositivos médicos.
- En marzo de 2023, ARCHIMED, una firma de inversión líder centrada en las industrias de la salud, financió a North America Science Associates Inc. (NAMSA) para adquirir SUAZIO, una firma de consultoría de marketing especializada en la comercialización de nuevos dispositivos médicos. Se espera que esta adquisición mejore el alcance de mercado de NAMSA al brindar oportunidades inmediatas de venta cruzada dentro de la industria.
Los requisitos reglamentarios más estrictos de la FDA alimentan la demanda de soluciones de prueba integrales. Además, la creciente tendencia a subcontratar servicios de pruebas permite a los fabricantes centrarse en las competencias básicas y, al mismo tiempo, garantizar el cumplimiento de las normas reglamentarias, aumentando así el crecimiento del mercado regional.
Se prevé que el mercado de pruebas de dispositivos médicos de Asia y el Pacífico sea testigo del crecimiento más rápido, registrando una tasa compuesta anual del 7,34% durante el período previsto. Esta expansión está impulsada por las crecientes demandas de atención médica y los avances tecnológicos.
- En julio de 2023, el ministro de TI, KT Rama Rao, lanzó tres dispositivos médicos desarrollados por Telangana Blue Semi, Huwel Lifesciences y EMPE Diagnosis para mejorar los servicios de prueba y creación de prototipos de dispositivos médicos.
Esta iniciativa subraya el compromiso de la región con la innovación y el desarrollo de capacidades locales en tecnología médica.
- Además, en enero de 2024, Tata Consultancy Services (TCS) introdujo un portal de ventanilla única para agilizar la importación de dispositivos médicos en la India. Este portal simplifica los procesos regulatorios, promueve un acceso más rápido al mercado para nuevos dispositivos y mejora la eficiencia en la cadena de suministro.
Las políticas gubernamentales de apoyo, el aumento de las inversiones en infraestructura sanitaria y la creciente prevalencia de enfermedades crónicas están aumentando la demanda de servicios avanzados.dispositivos médicosy servicios de pruebas. Además, centrarse en el cumplimiento normativo y el control de calidad respalda el crecimiento del mercado de Asia y el Pacífico.
Panorama competitivo
El informe sobre la industria mundial de pruebas de dispositivos médicos proporcionará información valiosa con énfasis en la naturaleza fragmentada de la industria. Los actores destacados se están centrando en varias estrategias comerciales clave, como asociaciones, fusiones y adquisiciones, innovaciones de productos y empresas conjuntas para ampliar su cartera de productos y aumentar sus cuotas de mercado en diferentes regiones.
Las empresas están implementando iniciativas estratégicas impactantes, como ampliar los servicios, invertir en investigación y desarrollo (I+D), establecer nuevos centros de prestación de servicios y optimizar sus procesos de prestación de servicios, que probablemente crearán nuevas oportunidades para el crecimiento del mercado.
Lista de empresas clave en el mercado de pruebas de dispositivos médicos
- SGS Société Générale de Surveillance SA
- Participaciones de la Corporación de Laboratorio de América
- Laboratorios Nelson, LLC
- TÜV SÜD
- Laboratorios Charles River.
- Asociados científicos de América del Norte, LLC
- Eurofins Científico
- Pace servicios analíticos LLC
- Grupo Intertek Plc
- Aplicación WuXi
Desarrollos clave de la industria
- Marzo de 2024 (Expansión):Stryker inauguró una nueva instalación en India dedicada a las pruebas del ciclo de vida de dispositivos médicos como parte de sus esfuerzos de expansión de laboratorio. Esta instalación tiene como objetivo desarrollar tecnologías médicas que cumplan con los más altos estándares regulatorios y mejoren los resultados de los pacientes. Equipado con un equipo capacitado de microbiólogos e ingenieros, el laboratorio ofrece amplias capacidades de pruebas microbiológicas para garantizar la seguridad y eficacia de los dispositivos médicos, junto con servicios de creación de prototipos y garantía de productos.
- Marzo de 2024 (lanzamiento del producto):TidalSense, una empresa de dispositivos respiratorios con sede en el Reino Unido, lanzó un estudio piloto para un dispositivo diseñado para diagnosticar el asma en niños.
El mercado mundial de pruebas de dispositivos médicos está segmentado como:
Por servicio
- Pruebas
- Inspección
- Proceso de dar un título
- Otros
Por abastecimiento
- Interno
- Subcontratado
Por clase de dispositivo
- Clase I
- Clase II
- Clase III
Por tecnología
- Dispositivo médico de implante activo
- Dispositivo médico activo
- Dispositivo médico no activo
- Dispositivo médico de diagnóstico in vitro
- Dispositivo médico oftálmico
- Dispositivo médico ortopédico y dental
- Otros
Por región
- América del norte
- A NOSOTROS.
- Canadá
- México
- Europa
-
- Francia
- Reino Unido
- España
- Alemania
- Italia
- Rusia
- Resto de Europa
- Asia-Pacífico
- Porcelana
- Japón
- India
- Corea del Sur
- Resto de Asia-Pacífico
- Medio Oriente y África
- CCG
- África del Norte
- Sudáfrica
- Resto de Medio Oriente y África
- América Latina
- Brasil
- Argentina
- Resto de América Latina
ELEGIR TIPO DE LICENCIA
Preguntas frecuentes (FAQ)
¡Obtenga las últimas novedades!
Obtenga estrategias prácticas para potenciar su negocio y dominar el mercado
- Entregue el impacto en los ingresos
- Patrones de oferta y demanda
- Estimación de mercado
- Información en tiempo real
- Inteligencia de mercado
- Oportunidades de crecimiento lucrativas
- Factores económicos micro y macro
- Soluciones de mercado futuristas
- Resultados basados en ingresos
- Liderazgo de pensamiento innovador
.webp)